Grupo del Dr. Takuya Nishigaki
Consorcio junto con los Drs. C. Treviño y A. Darszón
Fisiología Molecular de Espermatozoide y Biosensor fluorescente
Introducción
El batido flagelar del espermatozoide es una función fundamental debido a que cualquier defecto en el movimiento flagelar resulta en una deficiencia en la fertilidad. La forma y la frecuencia del batido flagelar cambian dinámicamente durante el proceso de fecundación. En mamíferos, el movimiento flagelar del espermatozoide inicia al momento de la eyaculación. En un principio, la forma del batido flagelar es simétrica con una amplitud baja y con una frecuencia alta. Este modo se llama 'activado' y produce un nado progresivo en un medio no viscoso (Fig. 1A arriba). En contraste, existe un modo vigoroso del batido flagelar llamado 'hiperactivación', el cual se observa en la ámpula del oviducto, donde ocurre la fecundación. El espermatozoide hiperactivado muestra un batido flagelar asimétrico, con una amplitud alta y una frecuencia reducida y no nada progresivamente en un medio de baja viscosidad (Fig. 1A abajo). Sin embargo, en un medio viscoso (y viscoelástico), el mismo espermatozoide muestra un nado progresivo (Fig. 1B). Se considera que la hiperactivación permite que el espermatozoide: 1) se despegue del epitelio del Istmo (un reservorio de los espermatozoide en el oviducto), 2) avance progresivamente en un ambiente viscoso (y visco elástico) y penetre eficientemente la matriz extracelular del óvulo como la capa de células cúmulus y la zona pelúcida (Fig. 1B)
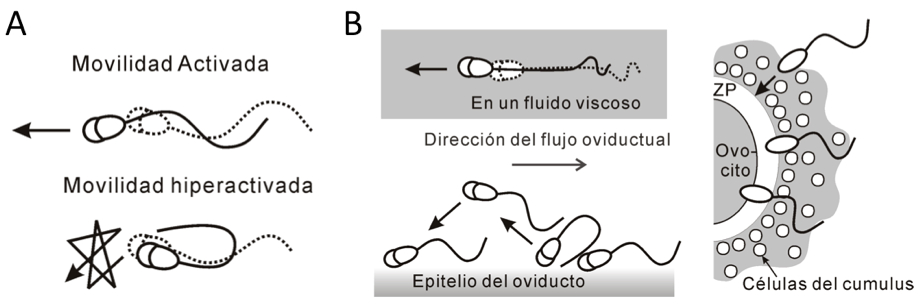
Figura 1. Movimiento de hiperactivación (A abajo) y su papel fisiológico en la fecundación (B).
Líneas de Investigación
Fisiología Molecular del Espermatozoide
Estamos trabajando para entender el mecanismo molecular que controla el batido flagelar del espermatozoide (hiperactivación), enfocándonos en los siguientes 4 parámetros fisiológicos incluyendo a las proteínas responsables de esos parámetros:
- El Ca2 intracelular, el cual depende principalmente del canal CatSper (canal de Ca2 específico del espermatozoide)
- El pH, considerando al sNHE (intercambiador Na /H específico del espermatozoide) y canal de H dependiente de voltaje.
- El AMP cíclico, cuya síntesis depende de la sAC (adenilato ciclasa soluble)
- El potencial de membrana plasmática, el cual podría modularse por los canales tetraKCNG/CNGK y Slo3 (canales de K )
Con respecto al sNHE, estamos trabajando con el dominio de unión a nucleótidos cíclicos (CNBD) que funciona como un switch molecular, el cual se encuentra presente en varias proteínas dependientes de AMP cíclico incluyendo el sNHE. Hemos desarrollado un ensayo de unión al CNBD con base a FRET (Transferencia de Energía por Resonancia entre Fluoróforos) (Fig. 2).
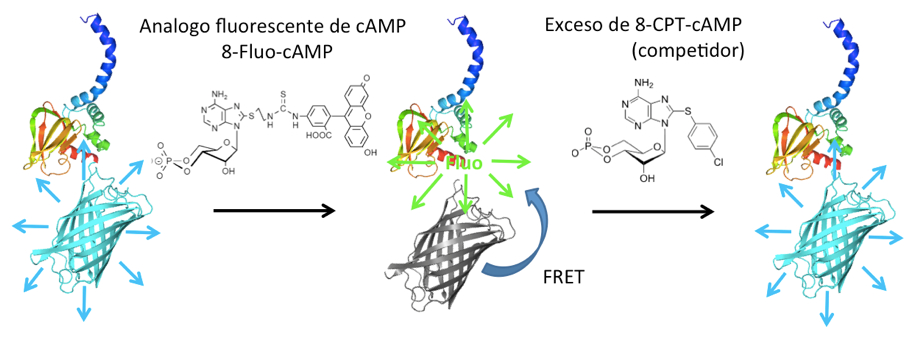
Figura 2. Esquema de un ensayo de FRET entre el CNBD-CFP y un análogo fluorescente del AMPc. CFP es una proteína fluorescente de color cian.
Biosensor fluorescente
Nuestro ensayo de unión basado en FRET nos permite caracterizar la interacción entre un dominio y un ligando, sin la necesidad de separar mecánicamente a las moléculas libres (no unidas) y al complejo, por lo que se ahorra tiempo y trabajo si lo comparamos con los métodos convencionales como ensayos de ELISA (Enzyme-Linked Immunosorbent Assay) y Pull-down assay.
Por otro lado, existen algunos ensayos de unión sin el proceso de la separación mecánica como la calorimetría de titulación isotérmica (ITC por sus siglas en inglés) y la anisotropía de fluorescencia. Sin embargo, estos ensayos requieren equipos especiales (nuestro instituto no cuenta con un equipo para ITC). Por lo anterior, nuestro ensayo con base en FRET es más sencillo, versátil y lo podemos realizar con un espectrofluorómetro y/o un lector de placas convencionales.
Considerando la ventaja del ensayo de unión basado en FRET usando proteínas fluorescentes (Fig. 3), estamos trabajando en el desarrollo de biosensores fluorescentes para disruptores endócrinos.
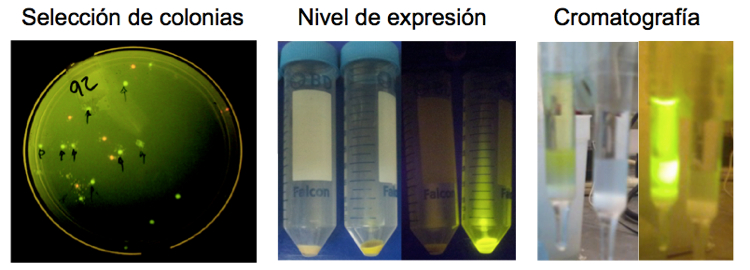
Figura 3. Ventaja de utilizar proteínas fluorescentes en la producción y purificación de proteínas recombinantes.
«Grupo»
Fisiología Molecular de Espermatozoide (y Biosensor fluorescente)
Objetivo del grupo (Investigación y Educación)
A pesar de que se han descubierto varias proteínas claves (como CatSper, el sNHE y la sAC descritos en la sección "Líneas de Investigación") para la regulación del batido flagelar del espermatozoide, no se sabe detalladamente la función y la regulación de cada proteína. Además, parece que existen diferencias significativas en la función y la regulación de estas proteínas entre las especies evolutivamente cercanas. Nuestro objetivo general de la investigación es describir el mecanismo molecular de la regulación del batido flagelar aclarando la función de cada proteína clave en las especies representativas como son el ratón y en el humano. A largo plazo, los conocimientos creados por nuestro grupo contribuirán a establecer diagnósticos moleculares de infertilidad masculina y el desarrollo de un anticonceptivo masculino.
Otro objetivo importante del grupo es entrenar personas para que puedan contribuir a la sociedad con disciplina, creatividad y capacidad de resolver problemas mediante nuestra actividad de la investigación. Una investigación requiere las siguientes tareas:
- buscar literatura, revisar bases de datos y ordenar información,
- proponer una idea (hipótesis),
- diseñar experimento(s) adecuado(s) para evaluar la hipótesis,
- realizar el(los) experimento(s),
- analizar el(los) resultado(s) y discutirlos con otra persona,
- presentar el(los) resultado(s).
Este ciclo de tareas se aplica tanto a un proyecto grande como a problemas cotidianos. Consideramos que es importante obtener pequeños éxitos de manera continua resolviendo problemas pequeños: esa es una forma segura para crear personas efectivas que puedan contribuir a cualquier línea de investigación independientemente del campo de estudio.
Esperamos a estudiantes con mucha motivación, de cualquier nivel (Licenciatura, maestría y doctorado) y de cualquier país.
Información personal del Dr Takuya Nishigaki.
Obtuvo el PhD en 1997 (Instituto Tecnológico de Tokio, Japón) con el trabajo de "Estructura y función de los péptidos activadores del espermatozoide de estrella de mar".
Posteriormente, realizó una estancia postdoctoral y fungió como Investigador Asociado en el grupo del Dr. Alberto Darszon (Instituto de Biotecnología UNAM) trabajando con la señalización del quimioatrayente de espermatozoide en erizo de mar. A partir de 2011, se convirtió en Líder Académico del mismo instituto formando el consorcio "Fisiología del espermatozoide" junto con el Dr. Alberto Darszon y la Dra. Claudia Treviño. Ha contribuido en la investigación de fisiología del espermatozoide mediante ensayos con fluorometría en alta resolución temporal, en el desarrollo de compuestos foto-activables y el establecimiento de microscopía de fluorescencia con iluminación estereoscópica con LED, etc. Su especialidad es la espectroscopia de fluorescencia (Apagamiento de fluorescencia, Anisotropía y FRET) y la señalización celular a través de canales iónicos y segundos mensajeros. Recientemente, tiene interés en la evolución (conservación y diversificación) sobre la regulación de Ca2 intracelular del espermatozoide (Fig. 1). En el instituto de Biotecnología, imparte clases de fluorescencia y sobre el mecanismo molecular de la percepción sensorial.
Métodos que utilizamos en nuestra investigación.
Microscopía
Es una herramienta fundamental en el grupo para observar la motilidad del espermatozoide, registrar Imágenes Fluorescentes y corrientes iónicas mediante Patch-Clamp. Para analizar el movimiento del espermatozoide de manera automática, contamos con un equipo CASA (computer assisted sperm analysis).
Biología Molecular
Es una técnica indispensable para trabajar con Proteínas Recombinantes tanto en la expresión de una proteína (o un domino de la proteína) como en células eucariotas (líneas celulares HEK293 y CHO) y bacterias (E. coli). Para esto, construimos Plásmidos que codifican cada proteína usando métodos convencionales de biología molecular. También, realizamos PCR para genotipificar Ratónes Transgénicos (nulo de sNHE) y averiguar la expresión de genes por RT-PCR.
Fluorometría
Existen varias tipos de Indicadores Fluorescentes (sensores fluorescentes) para determinar parámetros fisiológicos como Ca2 , pH y potencial de membrana plasmática. Usando estas herramientas, determinamos, en tiempo real, parámetros fisiológicos del espermatozoide a nivel de células individuales (Imágenes fluorescentes a través de Microscopía) o células en población (a través de un Espectrofluorómetro).
Electrofisiología
Es posible registrar corrientes iónicas a través de canales iónicos de células vivas con la técnica de Patch-Clamp usando una micropipeta de vidrio como electrodo. Aunque es muy difícil realizar registro de Patch-Clamp con un espermatozoide, es relativamente fácil realizar el mismo registro con Líneas Celulares como HEK293 y CHO. Nosotros sobre expresamos canales iónicos exógenos en la línea celular HEK293 y estudiamos su función.
Bioinformática
Gracias al avance de los proyectos de Genoma en varias especies, existen muchas especies de eucariotas que cuentan con su Genoma parcial o totalmente secuenciado. Por lo anterior, es posible realizar Genómica Comparativa de las proteínas importantes en la regulación de la movilidad del espermatozoide. Usando este método, hemos encontrado un patrón de Coevolución entre CatSper, sNHE y sAC en los Metazoarios.
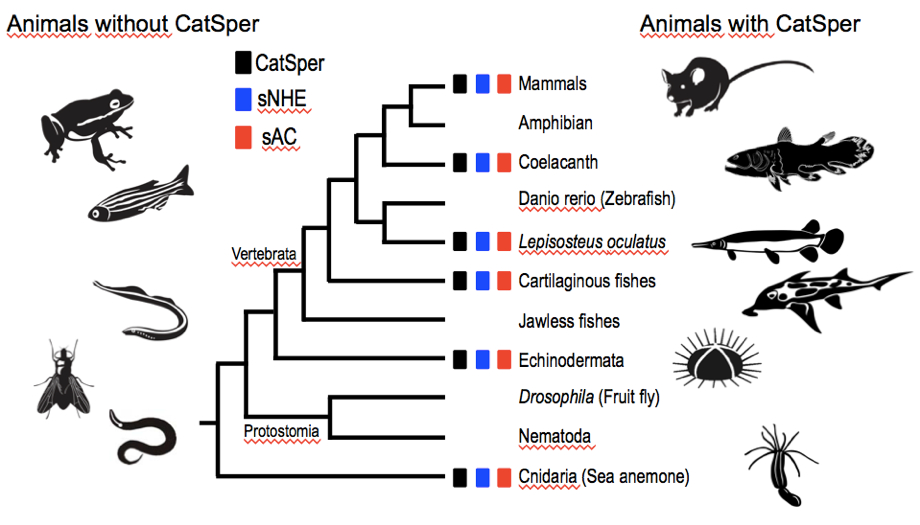
Figura 1. Distribución de CatSper, sNHE y sAC en animales.
-
Líder Académico
-
Administrativo
-
Dra. Ma. Del Carmen Beltran Nuñez
Investigador -
M.C. Yoloxochitl Sanchez Guevara
Técnico Académico
-
Doctorado
-
Maestría
-
Licenciatura
-
Estancia Temporal




